lotura kimiko
- 1. Kim.
- sin. lotura
Ioi, molekula eta abarretan atomoak elkarri lotuak iraunarazten dituen indarra. Lotura-mota hauek dira garrantzitsuenak: ionikoa, kobalentea (apolarra, polarra eta koordinatua), metalikoa eta hidrogeno-zubien bidezkoa.
- en bond, chemical bond
- es enlace, enlace químico
- fr liaison, liaison chimique
1. Kim.
-

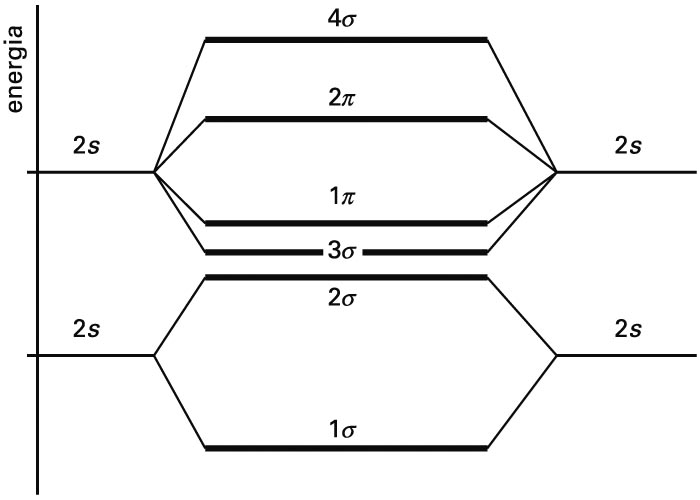
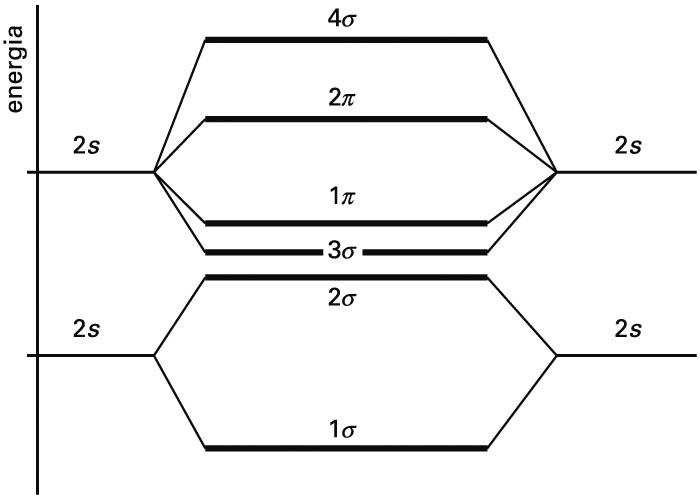
Molekula diatomiko homonuklear baten OMen energiak (erdian), eta jatorrizko orbital atomikoenak (ezkerrean eta eskuinean) -
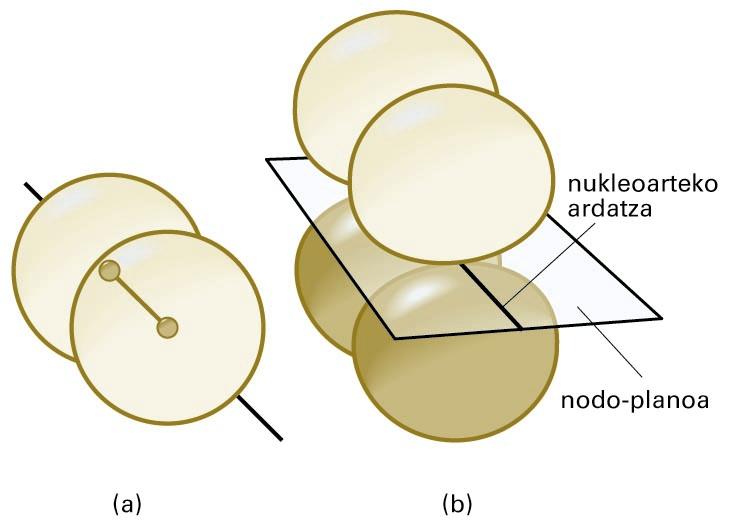
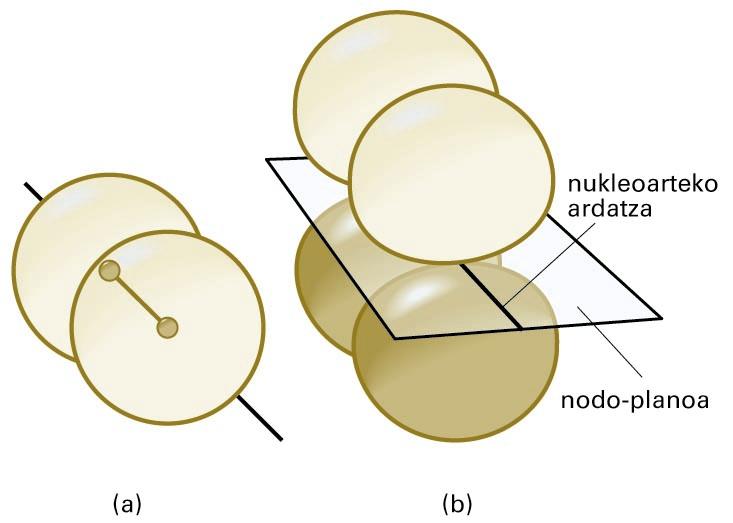
(a) σ orbital molekularra —kasu honetan, bi s orbital atomikoren konbinazioz lortua —; (b) π orbital molekular baten egitura —nukleoak nodo-planoan daude kokatuta— -
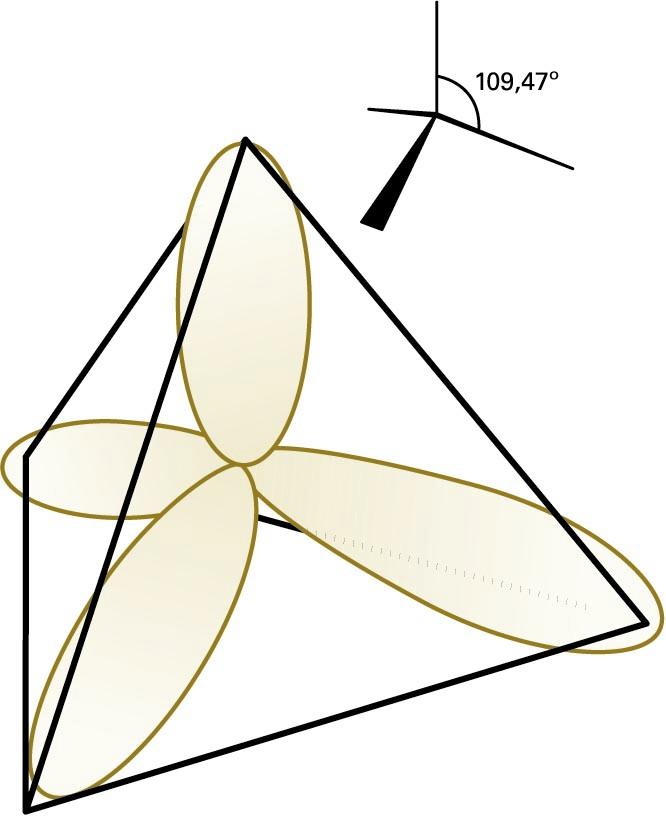
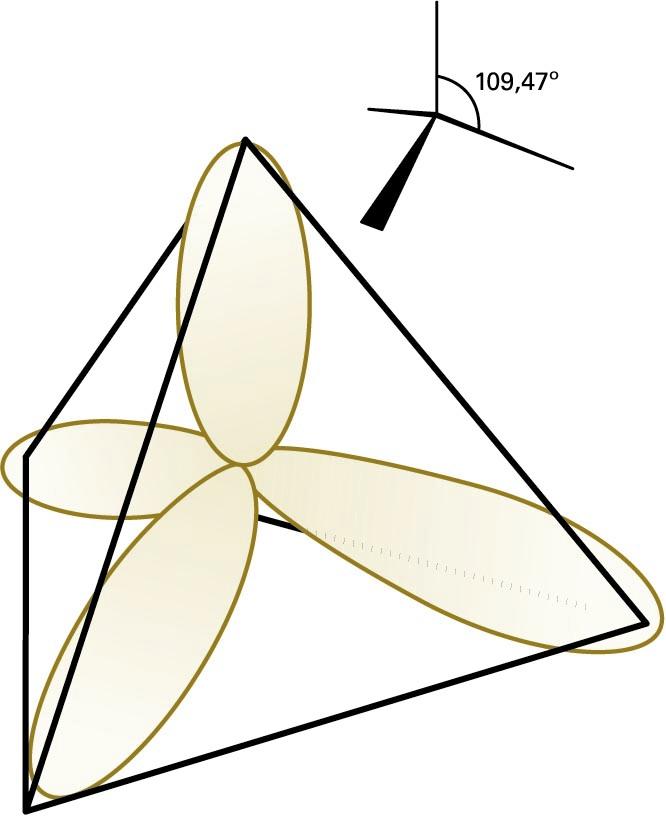
Karbonoaren sp 3 orbital hibrido tetraedrikoak -
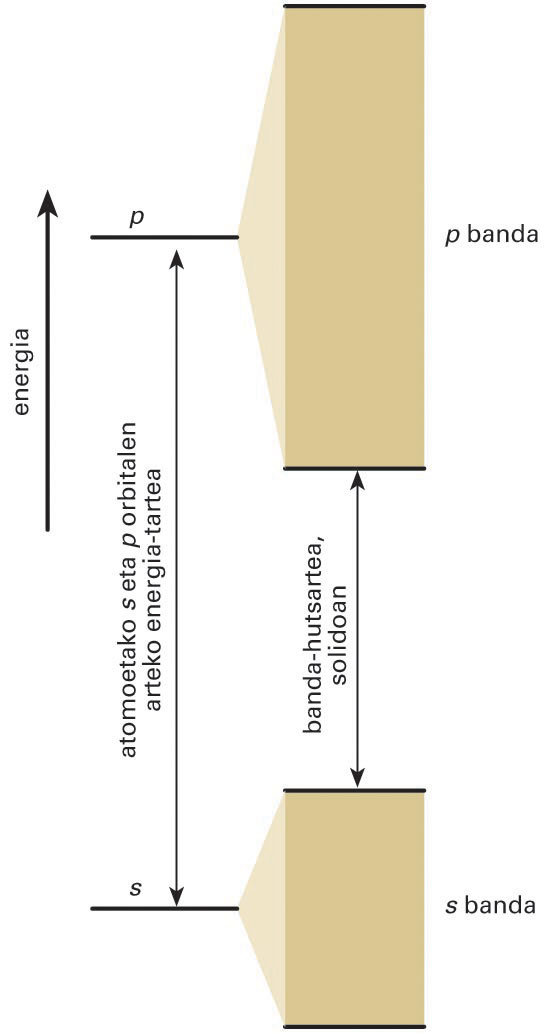
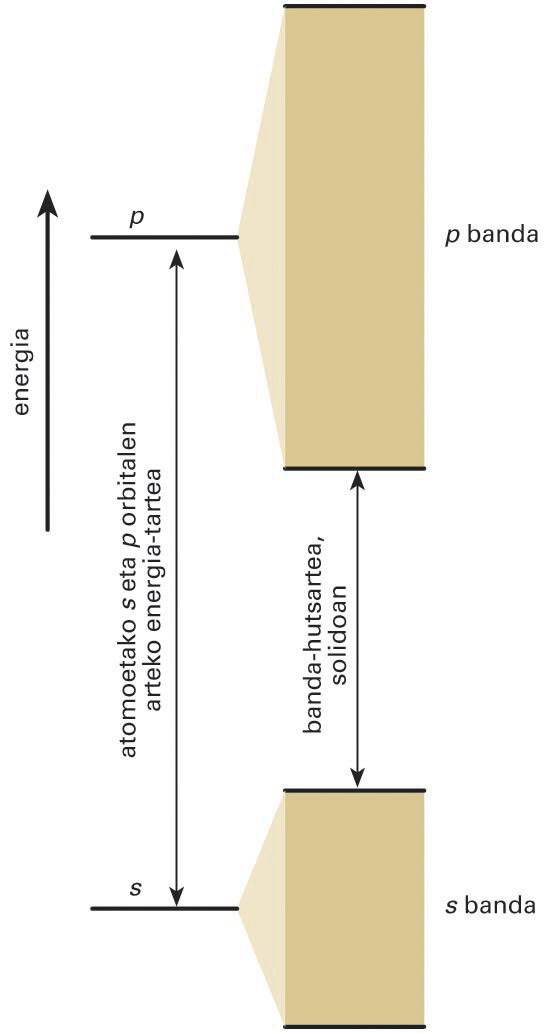
Solido metaliko batean, s orbitalen arteko gainjartzeak s banda ematen du, eta p orbitalen arteko gainjartzeak, p banda -
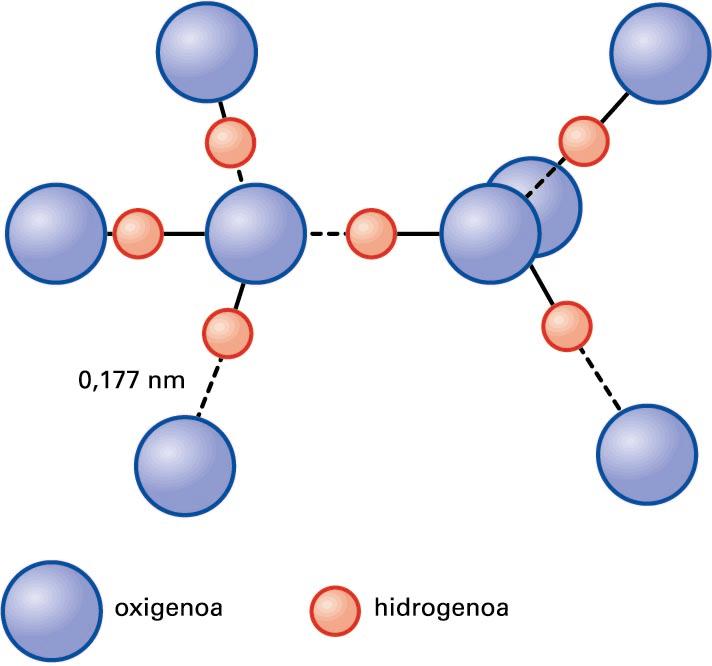
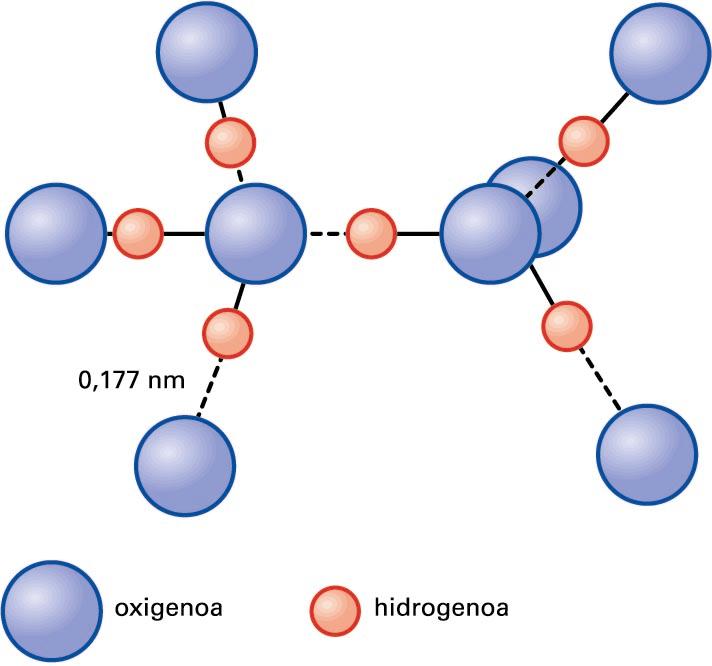
Ur-molekulen arteko hidrogeno-loturak (lerro etenen bidez adieraziak)
- 1. Kim.
- Ioi, molekula eta abarretan atomoak elkarri lotuak iraunarazten dituen indarra. Lotura-mota hauek dira garrantzitsuenak: ionikoa, kobalentea (apolarra, polarra eta koordinatua), metalikoa eta hidrogeno-zubien bidezkoa.
Lotura kimikoa Edit
Egilea: Francisco Basterretxea
Atomo eta molekulen artean gertatzen diren indarren bidez eratzen dira haien arteko loturak. Atomoak elkartu egiten dira molekulak sortzeko, lotura kimikoak eratuz. Lotura kimikoen energiak handiak dira (kasu gehienetan, 200-800 kJ/mol artekoak). Molekulen arteko indarrak edo Van der Waalsen indarrak askoz ahulagoak dira (1-10 kJ/mol artean aurkitu ohi dira), baina oso garrantzitsuak dira. Lotura kimikoak hainbat eratakoak dira: lotura kobalentean, atomoek elektroiak partekatzen dituzte molekulak osatzeko; lotura ionikoan, atomoen artean erabateko elektroi-transferentziak gertatzen dira, ioiak sortzen baitira, eta indar elektrostatikoen bidez lotzen baitira. Muturreko bi kasu horien artean tarteko loturak daude, ekarpen ioniko eta kobalenteak dituztenak. Solido metalikoen kasuan, lotura metalikoaz hitz egiten da. Solido horietan, atomoak ionizatuta daude, eta elektroiak modu nahiko librean mugitzen dira kristal-sarean. Loturaren ezaugarriak ongi ulertzeko, mekanika kuantikoaren legeetara jo behar da.
Lotura kobalentea
Lotura kobalentea elektroiak partekatzen dituen lotura kimikoa da. A eta B atomoak elkar daitezke bakoitzak elektroi bat (edo gehiago) eskainiz lotura bat eratzeko; AB molekula osatzen da, eta bi atomoen arteko lotura A–B gisa adierazten da. Adibidez, bi hidrogeno-atomo (H), bakoitzak elektroi bat duela, elkar daitezke H2 hidrogeno-molekula sortzeko, bi elektroiak konpartituz. Elektroi-bikote bakarrez osatutako lotura-mota horri lotura bakun deritzo. Atomoek bi edo hiru elektroi-bikote ere parteka ditzakete, eta lotura bikoitzak edo hirukoitzak eratzen dituzte, hurrenez hurren. Lotura bikoitzaren adibidea O2 oxigeno-molekulan dugu, eta hirukoitzarena N2 nitrogenoaren kasuan.
Lotura kobalentea ulertzeko, mekanika kuantikoak bi teoria eskaintzen ditu, orbital molekularren teoria eta balentzia-loturaren teoria. Orbital molekularren teoriaren arabera, molekula osora hedatzen diren uhin-funtzioen bidez deskribatzen dira elektroiak, eta uhin-funtzio horiei orbital molekular (OM) deritze. Ψ orbital molekularra lortzeko, linealki konbinatzen dira molekula osatzen duten atomoen Φi orbital atomikoak:
non ci koefizienteak adierazten duen elektroia Φi orbitalean aurkitzeko probabilitatea. Adibidez, H2 molekulan, OM hau sor daiteke:
non 1s(A) eta 1s(B) bi hidrogeno-nukleoen 1s orbital atomikoak diren. Teoria honen arabera, orbital atomikoak egoki gainjartzen diren guneetan, dentsitate elektronikoa handitu egiten da, eta elektroiek modu eraginkorragoan erakarriko dituzte nukleoak. Horren ondorioz, molekularen energia jatorrizko atomoena baino txikiagoa izango da, eta horrek atomoen arteko lotura faboratzen du.
Zenbat orbital atomiko konbinatzen diren, hainbat orbital molekular lortuko dira, bakoitzak bere energia duela. Kimika kuantikoaren metodoak aplikatuz, orbital molekularren eta energien adierazpen zehatzak lortzen dira, Schrödingerren ekuazioa ordenagailu bidez ebatziz. Adibidez, molekula diatomiko baten orbital molekularren energiak kualitatiboki diagrama honetan erakusten dira. Irudian, jatorrizko orbital atomikoen energiak ezkerrean eta eskuinean adierazten dira, eta erdiko gunean orbital molekularrenak.
Molekula diatomiko homonuklear baten OMen energiak (erdian), eta jatorrizko orbital atomikoenak (ezkerrean eta eskuinean)
Molekula batean eratutako OMak hainbat formatakoak izan daitezke. Sigma (σ) OMak s edo p orbital atomikoak konbinatuz lortzen dira kasu gehienetan, eta simetria zilindrikoa dute nukleoarteko ardatzarekiko. Pi (π) OMen ezaugarrietako bat da nodo-plano bat dutela, bi nukleoetatik pasatzen dena. Nodo-plano batean, uhin-funtzioak zero balioa hartzen du, eta, ondorioz, elektroiak inguru horretan aurkitzeko probabilitatea txikia da. Sigma eta pi OMen forma irudi honetan ikus daiteke.
(a) σ orbital molekularra —kasu honetan, bi s orbital atomikoren konbinazioz lortua—; (b) π orbital molekular baten egitura —nukleoak nodo-planoan daude kokatuta—
Bi π OM daude energia berarekin, baina propietate desberdinak dituzte. Pi OM gehienak p orbital atomikoak konbinatuz lortzen dira, baina p-d edo d-d konbinazioetatik ere sor daitezke. Sigma OM batean dauden bi elektroik σ lotura eratzen dute. Pi OM batean dauden bi elektroik π lotura eratzen dute.
OM teoriaren arabera, orbital lotzaileak, antilotzaileak eta ez-lotzaileak era daitezke. OM lotzaileen energia atomoen orbital atomikoena baino txikiagoa da, eta, beraz, OM horiek loturaren sorrera faboratzen dute. Alderantziz, OM antilotzaileen energia jatorrizko orbital atomikoena baino handiagoa da, eta loturaren eraketaren kontra egiten dute. OM ez-lotzaileen energia jatorrizko atomoenaren antzekoa da, eta ez du lotura faboratzen ez oztopatzen. OM ez-lotzaileetan, jatorrizko atomoetako batek loturan partekatzen ez dituen elektroiak kokatu ohi dira, elektroi-bikote bakartiak deiturikoak. Adibidez, H20 molekulan, oxigeno-atomo bakoitzak hidrogeno-atomoekin partekatzen ez dituen bi elektroi-bikote ditu.
Aurreko OMen energia-diagramatik abiatuz, molekularen konfigurazio elektronikoa lor daiteke; elektroiak OM erabilgarri baxuenetan kokatzen dira, Pauliren esklusio-printzipioaren arabera. Pauliren printzipioak honako hau dio: orbital bakoitzean, gehienez bi elektroi sar daitezke, eta bi daudenean, haien spinek parekatuta egon behar dute, hau da, spinaren momentu angeluarraren erresultanteak zero izan behar du. Spinen parekatzea grafikoki adierazteko, ↑↓ sinboloa erabili ohi da. Zenbait kasutan, π OMetan adibidez, bi OMek edo gehiagok energia bera dute; horrelakoetan, OM horiek guztiz beteta ez badaude, elektroiek nahiago dute OM desberdinetan kokatu, eta spinak paraleloki jarri (↑↑). Konfigurazio elektronikoaren bidez, molekularen zenbait propietate uler daitezke. Esate baterako, loturaren sendotasunaren neurria lotura-ordenak ematen du. Molekula diatomiko batean, honela definitzen da LO lotura-ordena: LO = (n– n*)/2, non n eta n* OM lotzaileetako eta antilotzaileetako elektroi-kopurua diren, hurrenez hurren. Lotura-ordena hainbat propietate molekularrekin erlazionatuta dago; besteak beste, lotura-distantzia laburtzen da, loturaren disoziazio-energia igotzen da eta loturaren indar-konstantea handitzen da, LO handitu ahala.
Lotura kobalentea azaltzeko, beste teoria bat ere erabiltzen da: balentzia-loturaren teoria. Teoria horren arabera, molekula baten loturak eratzen dira atomo auzokideen balentzia-elektroiak parekatzen direnean. Orbital molekularren teorian, loturan parte hartzen duten elektroiak molekula osora hedatzen dira, eta balentzia-loturaren teorian, berriz, elektroiak molekulako bi nukleoren arteko eremuan kokatzen dira, nukleo horiek lotura lokalizatuen bidez elkartzen baitira. Balentzia-loturaren teoriak arrakasta izan du molekulen geometriak eta loturen arteko baliokidetasunak azaltzeko, hibridazio kontzeptuaren bidez. Atomo bereko bi orbital edo gehiago hibridatzen direla esaten da baldin eta elkarrekin nahasten badira hainbat norabidetako orbitalak emateko. Esate baterako, CH4 etanoaren egitura tetraedrikoa eta lau C−H lotura baliokideak azaltzeko, jo behar da karbonoaren 2s eta 2p orbitalak (lau guztira) konbinatu egiten direla lau sp3 orbital hibrido eratzeko —bakoitza tetraedro erregular baten erpinera zuzenduta (ikus hurrengo irudia)—. Karbono-atomoaren oinarrizko konfigurazio elektronikoa 2s2 2p2 den arren, 2s elektroi bat 2p orbitalera igotzen da, eta, hala, lau lotura eratzeko ahalmena lortzen du. Karbonoaren orbital hibrido bakoitzean, elektroi bat jarriko da, eta σ lotura bat eratuko du hidrogeno-atomo baten 1s orbitalaren spinarekin parekatuz.
Karbonoaren sp3 orbital hibrido tetraedrikoak
Aurrekoaz gain, hainbat orbital hibrido mota sor daitezke. Esate baterako, sp, sp2 eta sp2d hibridoek egitura lineala, triangeluar laua eta karratu laua dituzte, hurrenez hurren.
Lotura, solido ionikoetan
Alderantzizko zeinuko karga duten bi ioiren artean erakarpen elektrostatikoa gertatzen da, eta ioien artean lotura eratzen da. Molekula bakanen esparrura mugatzen bagara, lotura ionikoak elektroien erabateko transferentziaz gertatzen direla uler daiteke, eta, beraz, lotura kobalentearen beste muturreko kasua litzateke, lotura eratzen duen elektroi-bikotea atomo batek guztiz bereganatzen duenean. Esate baterako, kaltzio-atomoaren konfigurazioa [Ar]4s2 da (bi elektroi ditu balentzia-geruzan), eta kloro-atomoarena [Ne]3s2 3p5 ( bost elektroi, bete gabe dagoen 3p geruzan). Kaltzio-atomoak bi elektroi transferitzen baditu, Ca2+ ioi bihurtzen da, eta argonaren konfigurazio egonkorragoa lortzen du (bere energia jaisten da). Era berean, kloro-atomo bakoitzak elektroi bana jasotzen badu, Clˉ ioi bihurtzen da, eta argonaren konfigurazio egonkorragoa lortzen du. Hala, CaCl2-an, lotura Ca2+ eta Clˉ ioien arteko elkarrekintza elektrostatikoz osatzen dela jo daiteke.
Kasu gehienetan, lotura-mota hori solido ionikoetan gertatzen da, eta konposatuaren osagaietako bat metala da (adibidez, NaCl, CaCl2, MgF2). Ioi-kopuru handi baten agregazioz eratutako sistema balitz bezala, ioiak Coulomben elkarrekintzaren bidez elkartuta, irudika daitezke konposatu horiek: alderantzizko zeinuko kargek elkar erakartzen dute, eta zeinu berekoek, berriz, aldaratu; eta indar erresultanteak ioi-sistema elkartuta mantentzen du. Horren ondorioz, solido ionikoek fusio-tenperatura altuak dituzte, eta zaila da horiek tolestea edo deformatzea. Kristal ioniko baten egonkortasuna sare-energia ren bidez adierazten da. Kristal ioniko baten sare-energia da kristalaren 1 mol jatorrizko atomoen ioi gaseosoetan bereizteko behar den energia. Adibidez, sodio klorurorako, NaCl(s) → Na+(g) + Clˉ(g) prozesuaren energia 787 kJ/mol da.
Lotura, solido metalikoetan
Lotura-mota honek elkartuta mantentzen ditu metal solidoen edo aleazioen atomoak. Solido horietan, jo daiteke atomoak ionizatuta daudela, posizio finkoak betetzen dituztela kristal-sarean, eta balentzia-elektroiak modu nahiko librean mugitzen direla sarean zehar, elektroi-gasa delakoa osatuz. Lotura-indarra metalaren ioi positiboen eta elektroien arteko erakarpen elektrostatikoaren bidez sortzen da.
Lotura metalikoaren propietateak azaltzeko, banda-teoria erabiltzen da. Atomo bakar batean, elektroiek energia-maila diskretuak dituzte, mekanika kuantikoak agindu bezala. Banda-teoriaren arabera, atomo askoz osatutako kristal metaliko batean, elektroiek nukleo askoren eragina jasaten dute, eta haien energiak banda jarraituak bihurtzen dira, irudian agertzen den moduan.
Solido metaliko batean, s orbitalen arteko gainjartzeak s banda ematen du, eta p orbitalen arteko gainjartzeak, p banda
Orbital atomikoak s motakoak badira, haien artean konbinatzen direnean s banda osatzen dute. Ostera, p orbitalak konbinatuz, p bandak eratzen dira. Kasu askotan, energia-banda posible horien artean, banda debekatuak daude, banda-hutsarteak deiturikoak, eta horietan ezin da elektroirik aurkitu. Metalaren elektroiak banda posibleetako orbitaletan kokatzen dira, spinak parekatuz. Banda bat betetzeko adinako elektroirik ez badago, bandaren goialdean dauden elektroiak mugitu egin daitezke. Bete gabeko banda horri eroapen-banda deritzo, eta elektroiak banda horretan zehar garraiatzen dira. Elektroiz betetako bandei balentzia-banda deitzen zaie, eta horietan elektroiek ezin dute korronte elektrikorik garraiatu. Solidoen banda-egituraren bidez, substantzia horien eroaletasun elektrikoa eta termikoa uler daitezke.
Molekulen arteko indarrak
Geruza elektroniko beteak dituzten espezieen arteko erakarpen- eta aldarapen-indarrei molekulen arteko indar deritze. Adibidez, bi H2O molekulen arteko elkarrekintza mota honetakoa da. Indar hauek lotura kimikoenak baino askoz ahulagoak dira, baina garrantzi handia dute, besteak beste, gasen portaera ez-ideala azaltzeko, ura giro-presio eta -tenperaturan likidoa dela ulertu ahal izateko, edo proteinen egonkortasuna azaltzeko. Ioi-dipolo elkarrekintza da indar-mota esanguratsuena; ioi baten eta molekula polar baten (momentu dipolarra duena) arteko elkarrekintza coulombdarra da. Elkarrekintza-mota horren energiak 10 kJ/mol ingurukoak izan ohi dira, eta horien ondorioz disolbatzen dira konposatu ionikoak uretan. Dipolo-dipolo elkarrekintza molekula polarren artean gertatzen da, dipolo elektrikoen kargen arteko elkarrekintza elektrostatikoagatik. Aurrekoek baino energia baxuagoa dute (1 kJ/mol ingurukoa). Dipolo-dipolo induzitu elkarrekintzan, molekula polar batek aldameneko molekula bat polarizatzen du, karga-banaketa aldatzen da eta momentu dipolarra eragiten du. Hala, lehen molekularen dipoloaren eta dipolo induzituaren artean erakarpen elektrikoa gertatzen da. Dipolo induzitu-dipolo induzitu edo Londonen elkarrekintzan, molekula baten elektroi-dentsitatearen fluktuazioak aldiuneko dipoloa eratzen du molekulan; dipolo horrek, era berean, beste dipolo bat sorrarazten du aldameneko molekula batean, eta, ondorioz, bi molekulek elkar erakartzen dute. Energia hauek ere txikiak dira (1 kJ/mol ingurukoak). Londonen elkarrekintza molekula-mota guztien artean gertatzen da, nahiz eta apolarrak izan. Esate baterako, helio edo nitrogeno gasak kondentsa daitezke, eta Londonen indarren ondorioz gertatzen da prozesu hori. Molekulen artean indar aldaratzaileak ere existitzen dira, haien elektroi-dentsitateen arteko aldarapenetatik sortuak. Fenomeno hori Pauliren esklusio-printzipioaren ondorioa da. Molekulen arteko indarrez elkartutako atomoen arteko distantziak lotura kobalenteetakoak baino handiagoak dira.
Naturan, molekulen arteko lotura-mota oso garrantzitsua da hidrogeno-lotura. Hidrogeno-lotura bi molekulen arteko elkarketa da; protoi bat bi atomo ez-metaliko eta oso elektronegatiboren artean kokatzen denean, eta horietako batek balentzia-geruzan partekatzen ez duen elektroi-bikote bat duenean (elektroi-bikote bakartia) gertatzen da. Elementu horiek N, O edo F izaten dira. Lotura honela adierazten da: B···H–A; B eta A elementu elektronegatiboak dira. Elkarrekintza-mota hori protoiaren tamaina txikiari zor zaio, bi atomoren artean erraz kokatzen baita. Adibidez, uraren kasuan, O···H–O loturan, oxigeno-atomoak H–O loturako elektroiak erakartzen ditu. Hala, hidrogeno-atomoa positiboki kargatuago geratuko da, eta erakarpen elektrostatikoa gerta daiteke hidrogenoaren protoiaren eta beste oxigeno-atomoaren elektroi-bikote bakartiaren artean. Dena den, hidrogeno-lotura ez da guztiz lotura elektrostatikoa, eta neurri batean izaera kobalentea ere badu. Oxigeno-atomo bakoitzak bi elektroi-bikote bakarti dituenez, bi hidrogeno-atomorekin batera era ditzake loturak, irudian agertzen den bezala.
Ur-molekulen arteko hidrogeno-loturak (lerro etenen bidez adieraziak)
Hidrogeno-lotura da molekulen arteko elkarrekintza indartsuena (20 kJ/mol inguru). Haren presentziak substantzien lurrun-presioa jaisten du, eta egitura zurrunak bideratzen ditu solidoetan. Uraren propietate asko uler daitezke hidrogeno-loturaren bitartez. Adibidez, ur likidoan egitura partzialki ordenatua dago, H2O···H–O–H loturen bitartez. Likidoaren antolaketa bereziaren bidez, 0 °C-an, uraren dentsitatea izotzarena baino handiagoa da, eta, horregatik, izotzak flotatu egiten du ur gainean. Bestalde, hidrogeno-loturen ondorioz gertatzen dira DNA-kateen arteko elkarrekintzak.